Efecto de la Aplicación de dos bioproductos sobre algunas variables fisiológicas en el cultivo de la lechuga variedad Fomento 95 (Lactuca sativa, L).
Effect of the Application of two bioproductos on some physiologic variables in the cultivation of the lettuce variety Fomento95 (Lactuca sativa, L),
Luis Gustavo González Gómez(1)
Julio Cesar Terrero Soler(2)
Jorge Alberto Alejandre Rosa(3)
Anabel Oliva Lahera(4)
María Caridad Jiménez-Arteaga(5)
Mario de Jesús Alarcón Mok(6)
(1) Universidad de Granma. ggonzalezg@udg.co.cu. ORCID: https://orcid.org/0000-0001-8585-5507
(2) Centro de Investigaciones Biológicas del Noroeste: La Paz, Baja California Sur. jcsoler@gmail.com. ORCID: https://orcid.org/0000-0002-9082-5588
(3) Universidad Veracruzana. Orizaba-Cordoba mexico.jalejandre@uv.mx. https://orcid.org/0000-0002-1252-4966
(4) Universidad de Granma. Bayamo. Granma. Cuba. aolival@udg.co.cu.
ORCID: https://orcid.org/0000-0003-4650-4645
(5) Universidad de Granma. cjimeneza@udg.co.cu.
ORCID: https://orcid.org/0000-0003-4761-8249
(6) Universidad de Oriente. Centro Universitario Municipal de Contramaestre. alarconmok@gmail.com . ORCID: https://orcid.org/0009-0001-0116-5179
Contacto: ggonzalezg@udg.co.cu
Artículo recibido el 6/marzo/2024. Aprobado 05/abril/2024
Resumen
La investigación se desarrolló en el Organopónico “Antonio Ñico López” conocido como el “18 Plantas”, ubicado en el Consejo Popular Jesús Menéndez. Se realizaron dos experimentos, entre los meses de noviembre – diciembre de 2023, con el objetivo de evaluar el efecto de dos bioproductos sobre algunas variables fisiológicas y el rendimiento de la lechuga. Seleccionando 9 canteros con una longitud 20 m largo x 1.20 m de ancho y se trasplantaron posturas de la variedad de lechuga Fomento 95. Se montaron los experimentos sobre un diseño de block al azar con tres réplicas y tres tratamientos. En el primer experimento los tratamientos fueron aplicados a los 7 días después del trasplante y en el segundo a los 9 días después del trasplante. Tratamientos realizados: T1- Control, T2 - Ácido Piroleñoso T3- Quitomax® ®. Variables fisiológicas evaluadas: Fluorescencia de origen, Fluorescencia máxima, relación Fv/Fm, Tiempo para alcanzar la máxima intensidad de fluorescencia y Área, además el rendimiento. Los datos fueron procesados en el software estadístico STATISTICA, cuando existió normalidad y homogeneidad se realizó un análisis de varianza doble (ANOVA), cuando éste fue significativo al 5% de probabilidad de error, las medias fueron comparadas por la prueba de Rangos Múltiples de Tukey (p<0.05). Se concluye la poca variabilidad de las variables fisiológicas evaluadas y si sobre el rendimiento con 3,35 y 2,73 kg m2 con la aplicación de Quitomax® ® y de 2,95 y 2,66 kg m2 donde se ap0licó Acido Piroleñoso a los 7 y 9 días después del trasplante respectivamente.
Palabras claves: Acido Piroleñoso, Quitomax®, rendimiento.
Abstract
The research was carried out at the “Antonio Ñico López” Organopónico, known as “18 Plantas”, located in the Jesús Menéndez Popular Council. Two experiments were carried out, between the months of November - December/2023, with the objective of evaluating the effect of two bioproducts on some physiological variables and the performance of lettuce. Selecting 9 beds with a length of 20 m long x 1.20 m wide and positions of the Fomento 95 lettuce variety were transplanted. The experiments were set up on a randomized block design with three replications and three treatments. In the first experiment, the treatments were applied 7 days after transplantation and in the second, 9 days after transplantation. Treatments performed: T1- Control, T2 - Pyroligneous Acid T3- Quitomax® ®. Physiological variables evaluated: Source fluorescence, Maximum fluorescence, Fv/Fm ratio, Time to reach maximum fluorescence intensity and Area, as well as performance. The data were processed in the STATISTICA statistical software. When normality and homogeneity existed, a double analysis of variance (ANOVA) was performed. When this was significant at a 5% error probability, the means were compared by Tukey's Multiple Range test. (p<0.05). It is concluded the little variability of the physiological variables evaluated and whether on the performance with 3.35 and 2.73 kg m2 with the application of Quitomax® ® and 2.95 and 2.66 kg m2 where Pyroligneous Acid was applied at 7 and 9 days after transplant respectively.
Keywords: Pyroligneous Acid, Quitomax® ®, yield.
Introducción
La lechuga (Lactuca sativa L.) es la hortaliza de hoja más de mayor consumo y comercio a nivel mundial, debido a sus características culinarias y aceptación cultural, así como su alta producción a través del año (ABCSEM, 2017).
En Cuba, ante la necesidad de incrementar el consumo de hortalizas a la población, se establecieron y desarrollaron los organopónicos y huertos intensivos, como formas de producción para lograr altos rendimientos y comercializar todo el año, garantizando la nutrición variada de la población (Pérez et al., 2018).
Jaramillo et al. (2018), señalan que aunque el mayor contenido de las lechugas sea agua, con un promedio de 95% de esta sustancia, aporta una cantidad nada despreciable de Calcio y Fósforo y otros minerales importantes como Zinc y Hierro, el aporte de grasas es bajísimo por lo que se la recomienda para personas que sufren de obesidad o en dietas de diabéticos.
En los últimos años, la obtención de altos rendimientos de los cultivos se ha visto limitada por diferentes factores, como: baja proporción de áreas bajo riego, incidencia de plagas, suelos erosionados y pocos insumos para la fertilización. Se hace necesaria la búsqueda de nuevas tecnologías para la obtención de rendimientos superiores, sin la utilización de fertilizantes minerales, ya que económicamente resultan costosos y su uso excesivo y continuo afecta los suelos y el medio ambiente (Mosqueda et al., 2018).
Entre estas alternativas que puede utilizar la agricultura ecológica, destaca el uso de bioestimulantes, en aras de lograr un desarrollo agrícola ecológicamente sostenible, que permita una producción a bajo costo, que no contamine el ambiente y mantenga la conservación del suelo con fertilidad y biodiversidad (Carvajal, et al., 2012).
El quitosano (principio activo del Quitomax®) estimula el crecimiento de las plantas, acelera el ciclo de los cultivos, contribuye a mantener el balance hídrico en las plantas, influye de manera marcada en el incremento del rendimiento y sus componentes y alarga la vida postcosecha de los frutos (Reyes et al., 2019).
Este acido piroleñoso es un producto procedente de la pirolisis de
especies
madereras, producto de la descomposición de biomasa y que puede
realizarse en ambientes favorables y controlados. Varios países
promocionan como fuente de tecnologías limpias el empleo de recursos
naturales sustituibles como medidas de mitigación ante los efectos del
cambio climático y los riesgos en la salud (Grewal, Abbey, y Gunupuru,
2018).
Es por ello que el objetivo general planteado en este trabajo se refiere a la “Evaluación de dos bioproductos sobre algunas variables fisiológicas al aplicarlo en el cultivo de la lechuga variedad Fomento 95 en condiciones de organopónico”
Materiales y métodos
La investigación se desarrolló en el Organopónico “Antonio Ñico López, ubicado en el Consejo Popular Jesús Menéndez del municipio de Bayamo, provincia Granma.Cuba, sobre un suelo construido artificialmente con suelo transportado y materia orgánica de diversas procedencias, en el período comprendido de 14 de noviembre - 14 de diciembre del 2023.
Se realizó el experimento sobre un diseño de block al azar con tres réplicas y tres tratamientos. En el primer experimento los tratamientos fueron aplicados a los 7 DDT (días después del trasplante) y en el segundo a los 9 DDT.
Los tratamientos evaluados fueron:
T1- Control (aplicación de H2O a los 7, 14, DDT)
T2 - Ácido piroleñoso (aplicación de manera foliar en dosis de 17 mL L-1 H2O a los 7, 14 DDT)
T3- Quitomax® ® (aplicación de manera foliar en dosis de 0,3 mL L-1 H2O 7 DDT).
Se seleccionaron 10 plantas por cada réplica y con el equipo Leaf Chamber & Soil Respiration Analysis System fabricado en el Reino Unido y Fluorímetro Marca. Handy P.E.A, se evaluaron las siguientes variables (ver manual de funcionamiento del equipo):
Fo: Fluorescencia de origen. Se manifiesta cuando el primer electrón estable del Foto sistema II llamado Qa se encuentra completamente oxidado (μmol m -2 s-1).
Fm: Fluorescencia máxima, cuando todos los RCs están cerrados, cuando la intensidad de la luz actínica es mayor a 500 µmol m-2 s-1 siempre que todos los RCs están activos como QA reducida)
Fv/Fm: Se acepta como indicador de la eficiencia máxima del Foto sistema II. Es un parámetro muy sensible y efectivo que puede ser usado como indicador de estrés.
Tfm: Tiempo (en ms) para alcanzar la máxima intensidad de fluorescencia máxima
Área: Área entre la fluorescencia de la curva y la Fm (cm2).
Los datos excepto los de la relación Fv/Fm, fueron transformado con la fórmula X“= √X
En el inicio de la aplicación de los tratamientos (7 y 9 DDT) se realizó la primera medición en tres momentos, previo al momento de la aplicación (0) y a las 24 y 48 horas después de la aplicación.
A los 14 DDT para ambos experimentos (segunda medición) se realizó la segunda medición en tres momentos, previo al momento de la aplicación para del Ácido Piroleñoso (0) y a las 24 y 48 horas después de la aplicación y estos tres momentos para el tratamiento donde se había aplicado Quitomax® .
En el momento de la cosecha se evaluó:
Rendimiento: El rendimiento correspondió al peso del follaje del total de plantas por metro cuadrado, expresando los valores en kg m2.
Características Químicas del abono orgánico utilizado en el organopónico (Cachaza) según Laboratorio Provincial de Suelos del Ministerio de la Agricultura de Granma.
N(%) P(%) K(%) pH MO(%) C/N Cenizas (%) Ca(%) Mg(%) C.E dS m-1
1.98 0.87 0.12 7.0 61 18 39 4.84 3.9 0.99
Los datos obtenidos fueron analizados por medio de estadística descriptiva de variables continuas, para distribución normal, según test de Kolmogorov-Smirnov (Allen, 1976) para la bondad de ajuste y se aplicó la prueba Dócima de Levene para evaluar la homogeneidad de la varianza. Cuando existió normalidad y homogeneidad se realizó un análisis de varianza simple (ANOVA), cuando éste fue significativo al 5% de probabilidad de error, las medias fueron comparadas por la prueba de Rangos Múltiples de Tukey (p<0.05). Los datos fueron procesados en el software estadístico STATISTICA versión 10 sobre Windows.
Resultados y discusión
Con relación a la florescencia inicial (Fo), se puede observar en la tabla 1 que existió la tendencia a no existir diferencias significativas entre los tratamientos evaluados en la segunda medición (aplicación de Acido Piroleñoso) que existió diferencias significativas, siendo precisamente este tratamiento donde se reportó un mayor valor del indicador evaluado, por lo que parece ser que la composición química del Ácido Piroleñoso tiende a activar la florescencia inicial. En el resto de las evaluaciones (mediciones), no existieron diferencias significativas entre los tratamientos evaluados.
Algunos autores como refieren que la Fo es la Fluorescencia Mínima, cuando todas las estomas están abiertos (Govindjee, 2004). Ospina (2019) señala con respecto a la fluorescencia de la clorofila-a, que cuando se registran valores más altos para la fluorescencia inicial (Fo) y para fluorescencia máxima (Fm) en las plantas, se debe al mayor contenido de clorofila en ella, similar resultado obtuvo Benítez (2022), en los cultivos de pimiento y tomate en condiciones de casa de cultivos.
La tendencia general en cuanto al comportamiento de la fluorescencia máxima fue a no existir diferencias significativas entre los tratamientos evaluados Algunos autores refieren que la Fm o Fluorescencia máxima, ocurre cuando todos los estomas están cerradas o cuando la intensidad de la luz actínica es mayor a 500 µmol m-2 s-1 siempre que todos los estomas están activas (Maxwell, K.; Johnson, 2000)
| Tratamientos | Primera aplicación | Segunda aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 107,0 b | 133,5 | 129,5 ab | 151,0 | 155,0 b | 148,0 |
| Acido Piroleñoso | 145,0 a | 124,0 | 125,4 b | 133,0 | 172,0 a | 159,0 |
| Quitomax® | 149,2 a | 133,0 | 149,7 a | 151,4 | 152,8 b | 138,0 |
| EE | 0,54 | 0,82 | 0,64 | 0,42 | 0,53 | 0,72 |
Tabla 1: Comportamiento de la fluorescencia inicial (Fo) a los 7 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
La mayor parte de la fluorescencia de la clorofila-a, se origina en el complejo antena (LHC) del fotosistema II y se emite como fluorescencia a 680 nm (Baker y Oxborough, 2004). Los valores obtenidos en cada momento de la evaluación tienden a estar alrededor de este valor señalado por estos autores.
Alvarado (2016) con relación a los valores de la Fm obtenida en 7 cultivares de arroz fueron entre 761 y 900 μmol m -2 s-1, valores que están por debajo a los obtenidos en este trabajo, lo cual lo asociamos a la morfología de las hojas de ambos cultivos (tomate y arroz), que son muy diferentes.
Los valores obtenidos reflejan el buen estado sanitario del cultivo de la lechuga evaluada en este caso.
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 405,0 | 600,0 | 547,0 | 619,8 b | 725,0 | 604,0 |
| Acido Piroleñoso | 570,0 | 644,0 | 502,2 | 512,0 c | 825,0 | 517,0 |
| Quitomax® | 599,0 | 600,0 | 627,5 | 718,0 a | 570,0 | 634,0 |
| EE | 1,05 | 1,43 | 1,32 | 0,96 | 0,78 | 0,69 |
Tabla 2: Comportamiento de la fluorescencia máxima (Fm) a los 7 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Con relación a la relación Fv/Fm, no existieron diferencias significativas entre los tratamientos evaluados, en las mediciones efectuadas (tabla 2).
González et al., (2008) señalan que los valores de la fluorescencia varían con la temperatura desde 25 oC a 45 oC con valores de 224 a 258 para la F(o), de 1169 a 613 para F(m), 945 a 355 para la F(v) y de 0,808 a 0,579 para la relación Fv/Fm, como refiere este autor a medida que se incrementa la temperatura solo la F(o) se incrementan las otras disminuyen, los experimentos estuvieron ubicados en el mismo orden que refieren estos autores..
La relación Fv/Fm es una estimación de la eficiencia cuántica máxima de la actividad fotoquímica del PSII (sistema fotosintético 2), comenta González et al., (2008), es por ello que los valores obtenidos en ambas etapas no sufren prácticamente variaciones, demostrando que todos los procesos fisiológicos de las plantas en ambas etapas se desarrollan normalmente sin síntomas de estrés o carencias de agua o nutrientes (tabla 3).
Teniendo en cuenta que una disminución en la relación Fv/Fm indica una reducción en la eficiencia fotoquímica del PSII y una perturbación o daños en el aparato fotosintético, esta relación ha sido empleada para detectar perturbaciones en el sistema fotosintético causadas por el estrés salino como refieren Glynn et al., (2003).
De igual forma, Lichtenthaler et al., (2005) recomiendan determinar la relación Fv/F0 para detectar los cambios inducidos por el estrés, ya que contiene la misma información básica pero además amplifica pequeñas variaciones detectadas por la relación Fv/Fm, aspecto que consideraremos en futuras investigaciones.
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 0,73 | 0,76 | 0,70 | 0,75 | 0,78 | 0,66 |
| Acido Piroleñoso | 0,73 | 0,75 | 0,72 | 0,71 | 0,79 | 0,76 |
| Quitomax® | 0,70 | 0,77 | 0,72 | 0,78 | 0,72 | 0,77 |
| EE | 0,32 | 0,28 | 0,21 | 0,26 | 0,09 | 0,18 |
Tabla 3: Comportamiento de la relación entre la fluorescencia variable (Fv) y la máxima (Fv/Fm) a los 7 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Como se aprecia en la tabla 4, no existieron diferencias significativas entre los tratamientos, al evaluar el tiempo en que ocurre la fluorescencia máxima (Tfm). 48 horas después de efectuada la primera aplicación de los bioproductos.
Similares resultados refieren Benítez (2022), en el cultivo del pimiento y tomate y Moreno (2019) en el cultivo del pimiento, ambas en condiciones de casa de cultivos.
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 202,5 | 342,5 | 232,5 a | 288,0 a | 234,0 | 190,0 |
| Acido Piroleñoso | 226,6 | 268,0 | 190,0b | 184,0 c | 392,0 | 154,5 |
| Quitomax® | 225,5 | 315,0 | 235,0 a | 244,0 b | 264,0 | 350,0 |
| EE | 0,43 | 0,51 | 0,42 | 0,38 | 0,51 | 0,58 |
Tabla 4: Comportamiento de la Tfm a los 7 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Con relación del área foliar (tabla 5), se puede observar que eixtieron diferencias significativas entre los tratamientos evaluados a las 48 horas después de la aplicación de los bioproductos a los siete días después del trasplante (DDT).
Barroso (2015) refiere que el área foliar es imprescindible para evaluar indicadores de eficiencia fisiológica en el estudio de la respuesta de variedades e híbridos, ante diferentes ambientes o regímenes de manejo, los valores obtenidos por estos autores son inferiores a los reportados por este trabajo, parece ser que la diferencia se debe al método empleado, ellos lo calcularon manualmente y en este caso con el equipo INGA de fabricación belga.
Arozarena (2017) establecieron en su trabajo al evaluar tres variedades de pimientos que los incrementos en el área foliar se asocian al grado de desarrollo vegetativo alcanzado por las plantas y permiten suponer una actividad fotosintética de mayor eficiencia, consecuencia del superior aprovechamiento por planta, de la calidad agrícola del sustrato y la radiación solar incidente, atenuada por los tendales. Esta aseveración se cumple en este caso al existir diferencias entre los tratamientos en los rendimientos obtenidos en este experimento.
Los valores de la Fo más bajo tuvieron la tendencia de presentarse en el tratamiento control y los valores más altos en el tratamiento donde se aplicó Quitomax® , llegando a un máximo de 174.5 nm en el momento de la segunda medición, recordar que este efecto se debe al Quitomax® aplicado a los 7 DDT, lo que corrobora que este bioproducto contribuye a una mejor nutrición, mejor uso del agua y protege a las plantas tratadas con Quitomax® del ataque de plagas, coincidiendo con lo planteado por Martínez, Arnó y Escola (2016) al plantear que las plantas con baja clorofila pudieran haber sido afectadas por un déficit de agua, o por el suplemento incorrecto de nutrientes minerales, o por la propagación de enfermedades o plagas, no pueden aprovechar gran parte de la energía solar que reciben. (Tabla 6)
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 1,1 | 1,4 | 1,5 b | 1,6 | 1,64 c | 1,64 |
| Ácido Piroleñoso | 1,3 | 1,12 | 1,8 a | 1,8 | 2,0 b | 2,1 |
| Quitomax® | 1,5 | 1,1 | 1,8 a | 1,9 | 2,8 a | 2,81 |
| EE | 0,09 | 0,08 | 0,03 | 0,09 | 0,05 | 0,98 |
Tabla 5: Comportamiento del área foliar a los 7 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Algunos autores plantean que una posible vía por la cual los bioestimulantes incrementan el crecimiento de las plantas, es porque estas moléculas estimulan la actividad fotosintética; lo que provoca una mayor ganancia de esqueletos carbonados que pueden ser utilizados para la síntesis de proteínas según Ojeda (2015).1
| Tratamientos | Primera aplicación | Segunda aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 112,0 bc | 145,2 a | 129,0 ab | 140,25 b | 152,25 a | 131,5 |
| Acido Piroleñoso | 126,0 a | 124,0 b | 125,4 b | 143,0 b | 172,6 a | 139,8 |
| Quitomax® | 97,0 c | 133,0 ab | 149,7 a | 174,5 a | 108,25 b | 143,5 |
| EE | 1,2 | 1,5 | 2,5 | 10,05 | 7,1 | 6,8 |
Tabla 6: Comportamiento de la fluorescencia inicial (Fo) a los 9 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Con relación a la variable Fm, a partir de la primera aplicación, se evidencia en la tabla 7 que existió la tendencia de obtener los mayores valores en el tratamiento donde se aplicó el Ácido Piroleñoso con valor de 0,79 en la segunda medición en el momento de la aplicación y a las 24 h después de esta aplicación.
Por el análisis de la fluorescencia modulada (Fm) podemos conocer si
determinado factor ambiental tuvo efectos en la fotoquímica del PSII y
en la disipación no fotoquímica, como calor y el gradiente de pH. Estas
técnicas tienen aplicación en las pruebas de productividad agrícola en
función de tratamientos con fertilizantes, hormonas, pesticidas y
herbicidas; en ensayos de
selección de cultivos tolerantes a diferentes factores de estrés
(incluyendo cultivos transgénicos) de acuerdo a lo planteado por
Strasser, Srivastava y Tsimilli (2000).
Estos resultados demostraron que fue efectiva la aplicación de las atenciones culturales y que la aplicación de los bioproductos mejora la eficiencia de la Fm en el cultivo de la lechuga cuando se aplica a los 9 DDT.
Los valores obtenidos en este experimento señalan que los mismos pueden ser empleados para evaluar el buen comportamiento o no frente a una metodología de cultivo empleada en este caso la de organopónico y la época de siembra de la lechuga.
Por otro lado, también la Fm tienen aplicación en el estudio de la conducta de ecosistemas ante cambios globales, en la eco dinámica de sistemas hortícolas y forestales y en la utilización de algas y plantas como biorremediadores de aguas y suelos contaminados con metales pesados (Brack y Frank,1998).
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 383,0 | 573,0 b | 562,0 b | 632,0 b | 712,2 | 600,0 ab |
| Acido Piroleñoso | 392,0 a | 544,0 c | 502,2 c | 692,0 b | 825,0 | 590,0 b |
| Quitomax® | 390,5 | 600,0 a | 627,5 a | 857,3 a | 811,0 | 639,0 a |
| EE | 1,9 | 1,5 | 1,3 | 2,7 | 3,2 | 3,3 |
Tabla 7: Comportamiento de la fluorescencia media (Fm) a los 9 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Con el estudio de la relación Fv/Fm solo existió diferencia significativa entre los tratamientos en la segunda aplicación. En el resto de las mediciones no existió diferencias significativas ente los tratamientos. Cabe destacar que los valores obtenidos en este caso coinciden con otros trabajos como veremos más adelante. (Tabla 8)
Eficiencia fotosintética: se define como eficiencia quántica real del fotosistema II (PSII) a la eficiencia con la cual los electrones son procesados en la fotosíntesis por cantidad de luz absorbida y se expresa como la relación Fv/Fm, donde Fv es la fluorescencia variable y Fm es la fluorescencia máxima cuando una planta está adaptada a condiciones de luz (Maxwell y Johnson, 2000). En este caso se demostró la adaptación del cultivo de la lechuga a la época de siembra en que se ejecutó el experimento.
Peña (2008) al evaluar el efecto del nitrógeno sobre esta variable reporta valores entre 0,774 y 0,778 con una desviación estándar entre ± 0,025 a ± 0,035. Los valores obtenidos en este trabajo se mantienen cercanos a estos valores después de aplicados los dos bioproductos y generalmente con tendencia a no existir diferencias significativas entre los tres tratamientos evaluados
No existió la tendencia a incrementar la eficiencia fotosintética con la aplicación de los bioestimulantes, lo que coincide con Peña (2008), al aplicar diferentes dosis de nitrógeno en Ludwigia decurrens, W, conocida con el nombre común de “Clavitos”. Lo que demuestra que los bioproductos no producen variabilidad en la reducción del contenido de la clorofila y en la actividad de la Rubisco.
Por último, Bolhar-nordenkampf et al., (1989) consideran que los valores por encima de 0,75 e incluso 0,8 pueden considerarse que todos se encuentran dentro del rango considerado óptimo para un cultivo, si observamos la tabla veremos que existió la tendencia de que los valores obtenidos en los tratamientos donde se aplicaron los bioproductos estuvieran en ese rango.
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 0,57 | 0,73 | 0,71 | 0,77 ab | 0,78 | 0,58 |
| Acido Piroleñoso | 0,54 | 0,75 | 0,72 | 0,79 a | 0,79 | 0,75 |
| Quitomax® | 0,48 | 0,77 | 0,72 | 0,75 b | 0,78 | 0,77 |
| EE | 0,057 | 0,011 | 0,017 | 0,006 | 0,02 | 0,03 |
Tabla 8: Comportamiento de la relación entre la fluorescencia variable (Fv) y la máxima (Fv/Fm) a los 9 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Los bioestimulantes son productos que se aplican a las plantas con el propósito de mejorar su rendimiento, calidad y eficiencia productiva, pero que también pueden promover la tolerancia al estrés biótico y abiótico a través de complejos cambios regulados por procesos fisiológicos, bioquímicos y moleculares (Yakhin et al., 2017). En tal sentido, Song et al. (2014), reportaron un comportamiento similar con el uso con estos tratamientos obteniendo mejor actividad fotosintética en comparación con plantas sin tratar, así como se ha señalado una mayor acumulación de materia seca en plátano.
Según González, Perales y Salcedo (2008) el valor máximo de la fluorescencia (Fm) en el tiempo en el que se alcanza depende del protocolo experimental, aunque en condiciones fisiológicas normales se alcanza en alrededor de 1s. En este momento todos los centros de reacción están reducidos "cerrados", qP = 0 y qNP = 1. P es el punto de fluorescencia máxima debido a que el flujo de electrones desde PQ a través del complejo b/f es el paso más lento de la cadena fotosintética. (tabla 9)
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 111,8 ab | 374,0 a | 234,0 ab | 240,0 | 237,5 ab | 177,5 |
| Acido Piroleñoso | 98,0 b | 268,0 b | 190,0 b | 240,0 | 392,0 a | 190,0 |
| Quitomax® | 137,5 a | 315,0 ab | 235,0 a | 262,0 | 152,5 b | 197,5 |
| EE | 2,13 | 2,14 | 5,9 | 3,12 | 4,32 | 3,2 |
Tabla 9: Comportamiento de la Tfm a los 9 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Cuando se analiza el área foliar, se observa que solo en la medición a las 24 horas de haber realizado la segunda aplicación, obteniéndose los mejores resultados en esta última medición cuando se aplicó el Ácido Piroleñoso y los resultados más bajos cuando se aplicó Quitomax®. (tabla 10).
Arozarena et al., (2017) establecieron en su trabajo al evaluar tres variedades de pimientos que los incrementos en el área foliar se asocian al grado de desarrollo vegetativo alcanzado por las plantas y permiten suponer una actividad fotosintética de mayor eficiencia, consecuencia del superior aprovechamiento por planta, de la calidad agrícola del sustrato y la radiación solar incidente.
El índice de área foliar (IAF) es una expresión numérica que permite entender las relaciones entre acumulación de biomasa y rendimiento bajo condiciones ambientales imperantes de una región determinada (Arozarena, 2017) en este caso no difieren los tratamientos entre sí.
| Tratamientos | Primera aplicación | Segunda Aplicación | ||||
|---|---|---|---|---|---|---|
| 0 | 24 h | 48 h | 0 | 24 h | 48 h | |
| Control | 1,1 | 1,3 | 1,03 | 1,4 | 1,4 ab | 1,6 |
| Acido Piroleñoso | 1,08 | 1,1 | 1,8 | 1,4 | 1,8 a | 1,6 |
| Quitomax® | 1,3 | 1,1 | 1,0 | 1,6 | 1,2 b | 1,1 |
| EE | 0,3 | 0,06 | 0,11 | 0,21 | 0,04 | 0,92 |
Tabla 10: Comportamiento del área foliar a los 9 DDT. Letras iguales en la misma columna significan que existe diferencia significativa entre los tratamientos para p ≤ 5 %.
Evaluación del rendimiento en ambos experimentos.
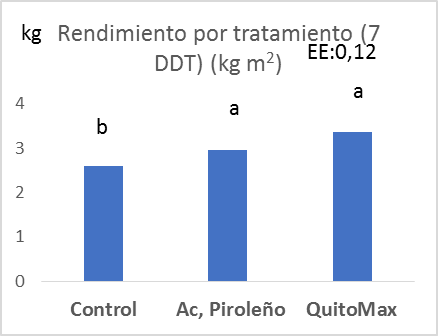
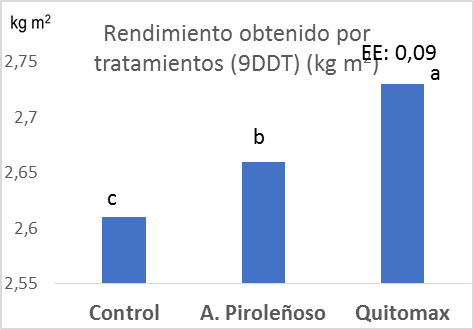
Tal como lo evidencia la figura 1, en los dos experimentos existió la tendencia a que el tratamiento donde se aplicó Quitomax® supera al resto de los tratamientos, excepto en el primero que no tiene diferencias significativas con el tratamiento donde se evaluó Quitomax® y se destaca que donde se aplicaron los bioproductos superaron al tratamiento control significativamente. Se convierten estos resultados en una alternativa viable económicamente para este cultivo ya que ambos bioproductos son de procedencia nacional.
Jiménez et al., (2013) estima un rendimiento promedio de 4,3 kilogramos por metros cuadrado, el cual es superior a los obtenidos en este trabajo.
Los resultados obtenidos de Quispe et al., (2018) son menores, cosechó a los 21 días después del trasplante y obtuvo un rendimiento de 2,575 kg m2 en sistema de raíz flotante. Este se parece a los resultados de Villafuerte (2020) que, alcanzó un rendimiento de 2,9 kg m2 los 30 DDT con la variedad Romana Parris Island.
Estudios realizados por Ardisana et al., (2020) con bioestimulantes y fertilizantes afectó significativamente el rendimiento total, así como el rendimiento comercial y la participación (%) de hojas de lechuga no comercializables, en comparación con la variante de control. De la misma manera, la respuesta positiva observada en el rendimiento de la lechuga podría estar relacionada con el incremento de la diversidad de microbiota en el sustrato después de la aplicación de microorganismos beneficiosos, lo que a su vez podría mejorar varios procesos fisiológicos como la actividad fotosintética, el crecimiento y la productividad de los cultivos (Morocho y Leyva, 2019).
Mientras que Núñez et al., (2015) reportan valores de 2.2 kg m2 para la variedad Fomento 95 tanto en condiciones de organopónico como de cultivo semiprotegido.
 |
 |
|---|
Figura 1: Rendimiento obtenido por tratamientos a los 7 y 9 DDT (kg m2).
Conclusiones
Al aplicar Ácido Piroleñoso y Quitomax® sobre el cultivo de la lechuga variedad Fomento 95 y evaluar algunas variables fisiológicas, la tendencia fue de no existir diferencias significativas entre los tratamientos aplicados, poniendo de manifiesto el buen estado nutricional del cultivo y su adaptabilidad a las condiciones climáticas y edáficas durante los dos experimentos.
El rendimiento de lechuga variedad Fomento 95 al alicar dos bioproductos en condiciones de Organoponía se puso de manifiesto el resultado positivo de estos al obtener valores de 3,35 y 2,73 kg m2 al aplicar Quitomax® y de 2,95 y 2,66 kg m2 con la aplicación del Ácido Piroleñoso a los 7 y 9 DDT, respectivamente, superando al tratamiento control el cual obtuvo valores de 2,59 y 2,61 kg m2 en ambos experimentos.
Bibliografías
ABSESEM Associação Brasileira Do Comercio De Sementes e Mudas – ABCSEM. 2017 Dados do setor. http://www. abcsem.com.br/dados-do-setor
Alvarado, H. 2016. Respuestas Fisiológicas de Siete Genotipos de Arroz (Oryza sativa L.) a diferentes Temperaturas Nocturnas. Tesis de Maestría. Universidad Nacional de Colombia Facultad de Ciencias Agrarias, Departamento de Agronomía Bogotá, Colombia.-
Ardisana, Eduardo Héctor., Antonio Torres-García.,
Osvaldo Fosado-Téllez
Soraya Peñarrieta-Bravo., Jorge Solórzano-Bravo.,
Vicente Jarre-Mendoza3
Fabián Medranda-Vera. 2020. Influencia de bioestimulantes sobre el
crecimiento y el rendimiento de cultivos de ciclo corto en Manabí,
Ecuador. cultrop vol.41 no.4 La Habana oct.-dic. 2020 Epub 01-Dic-2020
http://scielo.sld.cu/scielo.php?script
=sci_arttext&pid=S0258-59362020000400002
Arozarena, N. 2017. Cultivo semiprotegido: evaluación de distancias de plantación para pimiento (Capsicum annuum, L.) EN ÉPOCA ÓPTIMA. 1Instituto de Investigaciones Fundamentales en Agricultura Tropical “Alejandro de Humboldt” y 2UBPC Fernando García Rosales, MINAZ Habana.
Baker, N. R.; Oxborough, K.:2004 Chlorophyll fluorescence as a probe of photosynthetic productivity. In Chlorophyll a Fluorescence; Springer, 2004; pp 65-82.
Barroso, F. L.; Abad, M. M.; Rodríguez, H. P. y Jerez, M. E. 2015. “Aplicación de FitoMas-E y EcoMic® para la reducción del consumo de fertilizante mineral en la producción de posturas de cafeto”. Cultivos Tropicales, vol. 36, no. 4, pp. 158-167, ISSN 0258-5936, [Consultado: 14 de febrero de 2017], Disponibleen: <http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0258-5936201500040 0021&lng=es&nrm=iso&tlng=pt.
Benítez, M. 2022. Aplicación de tres bioproductos en los Cultivos de tomate y pimiento. Tesis de Maestría. Facultad de Ciencias Agropecuarias. Universidad de Granma.
Bolhar-nordenkampf H, Long S, Baker N, Öquist G, Schreiber U, Lechner R, 1989 Chlorophyll fluorescence as a probe of the photosynthetic competence of leaves in the field: a review of current instrumentation. Functional Ecology, 3: 497–514.
Brack W, Frank H 1998 Chlorophyll a fluorescence: A tool for the investigation of toxic effects in the photosynthetic apparatus. Ecotoxicol Environ Saf. 40:34-41.
Carvajal-Muñoz JS, Carmona-Garcia CE. 2012. Benefits and limitations of biofertilization in agricultural practices. Livestock Research for Rural Development. 24(3):1-8.
Glynn, P.,C., FraseryA.Gillian. 2003.Foliar salt tolerance of Acer genotypes using chlorophyll fluorescence. J. Arboriculture 29(02). 61-65.
González, S. Perales, H, y Martha, Salcedo. 2008. La fluorescencia de la clorofila a como herramienta en la investigación de efectos tóxicos en el aparato fotosintético de plantas y algas Rev 27(4): 119-129,
Govindjee, G. 2004. Chlorophyll a fluorescence: a bit of basics and history.Chlorophyll a fluorescence: a signature of photosynthesis Springer, Dordrecht, 1- 42.
Grewal, A., Abbey, L., Gunupuru, L. 2018. Production, prospects and
potential
application of pyroligneous acid in agriculture. Journal of Analytical
and
Applied Pyrolysis. 135, 152–159. https://doi.org/10.1016/j.jaap.2018.09.008.
Jaramillo Noreña., J; Aguilar., PA; Tamayo Molano., PJ; Arguello Rincón., EO. Guzmán Arroyave., M. CORPOICA. 2018. Modelo Tecnológico para Lechuga en el Buenas Prácticas Agrícolas Bajo el Cultivo de Oriente Antioqueño. Medellín,Colombia.https://conectarural.org/ sitio/ sites/default/files/ documentos /MANUAL %20DEL%20 CULTIVO%20DE% 20LA% 20LECHUGA. Pd.
Jiménez Arteaga, María Caridad., Luis Gustavo González Gómez., Alejandro Falcón Rodríguez, Siasmil Espinosa Montero. 2013. Evaluación de tres bioestimulantes en lechuga en condiciones de organopónico. Centro Agrícola, 40(1):79-82; enero-abril, 2013. http://cagricola.uclv.edu.cu/index.php/en/20-volumen-40-2013/numero-1-2013/147-evaluacion-de-tres-bioestimulantes-en-lechuga-en-condiciones-de-organoponico
Lichtenthaler, H. K., C.Buschmanny M.Knapp. 2005. How to correctly determine the different chlorophy ll fluorescence parameter sand the chlorophy ll fluorescence decrease ratio RFdo fleaves with the PAM fluoro meter. Photosynthetica 43 (3), 379- 393
Martínez-Casasnovas., A.,Arnó, J. y Escolà, A. 2016. ¿Qué nos dicen los sensores sobre los cultivos?. A g r i c u lt u r a d e p r e c i s i ó n. www.new ag international.com
Maxwell, K.; Johnson, G. N. 2000. Chlorophyll fluorescence—a
practical guide.
Journal of experimental botany 2000, 51, 659-668
Moreno, Lisset. 2019. Aplicación de tres bioproductos en los Cultivos de tomate y pimiento. Tesis de Maestría. Facultad de Química. Universidad de Oriente.
Morocho, M. y Leyva, M. 2019. Microorganismos eficientes, propiedades funcionales y aplicaciones agrícolas. Centro. Agr. vol.46 no.2 Santa Clara abr.-jun. 2019
Mozqueda-Barrientos, JR., Juárez-Maldonado, AA, González-Morales, SCA. Benavides-Mendoza, ACA. 2018. Aplicación de bioestimulantes innovadores y su impacto en el vigor y rendimiento del cultivo de tomate (Solanum lycopersicum L). http://repositorio.uaaan.mx:8080/xmlui/handle/123456789/ 43061
Núñez, B., Ibañez, D., Liriano, R., Broche, N. 2015. Evaluación del cultivo de la lechuga (Lactuca sativa L.) bajo los sistemas de organoponía y semiprotegido. Centro Agrícola, 42(3): 41-47; julio-septiembre, 2015. https://www.google. com/search?client=firefox-b-&q=Mientras+que+N%C3%BA%C3%B1ez+et+al. %2C+%282015%29+reportan+valores+de+2.2+kg+m2+para+la+variedad+ Fomento+95+tanto+en+condiciones+de+organop%C3%B3nico+como+de+cultivo+semiprotegido.
Ojeda, CM. 2015. Efecto de un producto bioactivo compuesto por oligogalacturónidos como mitigador del estrés hídrico en variedades de albahaca (Ocimum basilicum L.) [Tesis de Doctorado]. [La Paz, Baja California Sur, México]: Centro de Investigaciones Biológicas del Noroeste, S.C.; 2015. 47-123
Ospina, B. 2019. Estudio del quenching no fotoquímico de la fluorescencia de clorofila y parámetros fotosintéticos relacionados en plantas y algas. Tesis presentada para optar al título de Doctor de la Universidad de Buenos Aires en el área Química Inorgánica, Química Analítica y Química Física. Universidad de Buenos Aires Facultad de Ciencias Exactas y Naturales Departamento de Química Inorgánica, Analítica y Química Física. `-179
Páez, E. 2013 “La Agricultura Urbana y Suburbana en el contexto cubano”, Agricultura Orgánica, ISSN: 19 (1): 1028-2130, 2013.
Peña, E. 2008. Crecimiento y eficiencia fotosintética de Ludwigia decurrens Walter (ONAGRACEAE) bajo diferentes concentraciones de nitrógeno. Universidad del Valle. Colombia. Acta Biológica Colombiana. https://www.research gate.net/publication/28212106
Pérez Soto, F., Figueroa Hernández, E., Godínez Montoya, L., García Nuñez, RM., Rocha Quiroz, J. 2018. Sistemas de Producción y Cultivos Agrícolas en México [Internet]. ASMIIA,S.C.; Available from: handle/20.500. 11799/9919
Quispe., Y. C. y Chávez, C. M. F. 2017. Evaluación del efecto que tienen los microorganismos eficientes (EM), en el cultivo de pepinillo (Cucumis sativus L.), municipio de Achocalla.Apthapi, 3 (3): 652-666. [ Links ]
Reyes-Pérez, JJ., Enríquez-Acosta, E., Ramírez-Arrebato, MA., Rodríguez-Pedroso, AT., Lara-Capistrán, L., Hernández-Montiel, LG. 2019. Evaluation of the growth, yield and nutritional quality of pepper fruit with the application of Quitomax R©. Ciencia e Investigación Agraria 46: 35-46.
Song, A., Li, P., Fan, F., Li, Z., & Liang, Y. 2014. The effect of silicon on photosynthesis and expression of its relevant genes in rice (Oryza sativa L.) under high-zinc stress. PLoS One, 9(11):e113782. doi:10.1371/journal. pone.0113782
Strasser, RJ., Srivastava, A., Tsimilli-Michael, M. 2000. The fluorescence transient as a tool to characterize and screen photosynthetic samples. En: Probing Photosynthesis, Mechanism, Regulation, Adaptation. Editores: Yunus M, Pathre U, Mohanty P. Taylor & Francis. Pp 445-483
Villafuerte, C., 2020. Comportamiento agronómico de cuatro cultivares de lechuga (Lactuca sativa L.) mediante sistema hidropónico en la zona de Babahoyo, Provincia de Los Ríos.
Yakhin, O. I., Lubyanov, A. A., Yakhin, I. A., & Brown, P. H. 2017. Biostimulants in plant science: a global perspective. Frontiers in plant science, 7:2049. doi:10.3389/fpls.2016.02049/full.